罕见、致命、线粒体疾病!全方位一文解读Pearson综合征
2023-07-26 15:10 文章来源:
作者:周子琼
单位:广东省阳江市中医医院
摘要
Pearson综合征(PS)是一种罕见的致命性线粒体疾病,由单个大片段线粒体DNA缺失(SLSMD)引起。大多数患者在婴儿期出现贫血。骨髓涂片发现红系和髓系前体细胞胞浆空泡和环形铁粒幼细胞可以协助诊断,确诊需要检测SLSMD。线粒体疾病缺乏早期非血液学症状,因此PS需要与先天性再生障碍性贫血作重要鉴别诊断。
2/3的患者在1-3岁时出现贫血的自发消退,而累及多系统的非血液学并发症(如发育不全、肌张力减退、胰腺外分泌功能不全、肾小管病变和心功能不全等)在病程中发展。一些PS患者发展为Kearns-Sayre综合征。
在缺乏治愈手段的情况下,PS患者的预后不容乐观。大多数患者在儿童早期死于急性乳酸酸中毒和多器官衰竭。研究新的疗法来改变PS患者的寿命是非常有必要的。
背景
Pearson综合征(PS)最早由霍华德Pearson于1979年描述为难治性铁粒幼细胞性贫血伴骨髓前体细胞空泡化和胰腺外分泌功能障碍。九年后,Rötig等人发现PS是由线粒体DNA(mtDNA)缺失引起的。PS的患病率约为1:1000,000。迄今为止,全世界报告的病例不到150例。
PS是一种独特的原发性线粒体疾病(PMD),通常在婴儿早期表现为严重的低增生性贫血,随后出现进行性症状和多器官功能障碍,包括乳酸酸中毒、胰腺功能不全、肾小管病变、发育障碍、肌张力减退和内分泌紊乱。有趣的是,约2/3的PS患者出现贫血的自发消退,但是在其临床过程中转变为输血依赖。
目前为止,治疗方法仅限于对症治疗。PS患者的预后很差,大多数患者在6岁之前死亡。最近,由于PMD的新疗法开发,越来越多的人开始关注PS,其可能应用于患有这种罕见疾病的儿童。
正文
PMD是一组由病理性基因变异体mtDNA或核DNA编码引起的存在临床和遗传异质性的疾病,其特征在于线粒体呼吸链功能障碍。
mtDNA编码的13种多肽是复合物I、III、IV和V的必需亚基,以及翻译这13种多肽所必需的22种tRNA和2种rRNA。根据各个细胞类型的不同,人体内的线粒体DNA会有成百上千的拷贝。
许多PMD患者在同一细胞中具有野生型和突变型mtDNA的混合物,称为异质性。突变的mtDNA在不同组织中的分布不同,可能是由于早期细胞分裂过程中的随机分配。只有当异质性水平超过某个临界阈值(阈值效应)时,才会出现细胞功能障碍。
PS是由可变范围(1.5至8.0kb)位置的单个大片段mtDNA缺失(SLSMD)引起的。约40-50%的PS患者携带长度为4977 bp的“常见缺失”。SLSMD也见于患有慢性进行性眼外肌麻痹(CPEO)或Kearns-Sayre综合征(KSS)的儿童或年轻人,其特征在于PEO、色素性视网膜变性、共济失调和心脏传导阻滞。PS、CPEO和KSS形成了一系列连续的具有共同遗传表现的疾病,称为“mtDNA缺失综合征”,值得注意的是,在儿童早期存活的PS患者可发展为KSS样表型。
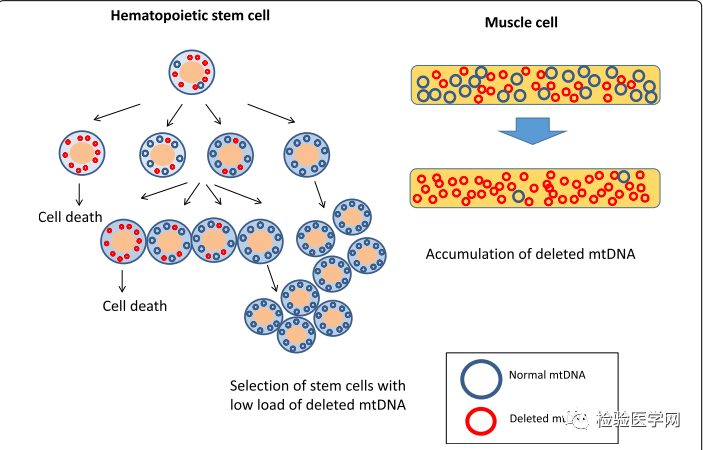
图1 Pearson综合征表型改变的假设。假设血液状态恢复是由于携带低负荷缺失的线粒体DNA(mtDNA)的造血干细胞的阳性选择。相反,缺失的mtDNA在肌肉中积累,导致Kearns-Sayre综合征的发展和肌肉相关并发症。
临床症状
PMD几乎影响所有组织和器官,特别是高度依赖于有氧代谢的器官,如肌肉和大脑。PS是一种临床上独特的PMD,缺乏提示PMD的其他特征,贫血通常是唯一的表现症状,其他常见的初始症状可见发育不良和胃肠道症状,如呕吐、腹泻和进食困难。
在我们最近发表的对25名PS患者的研究中,贫血发生的中位年龄为5个月(范围0-31个月)。怀孕和分娩期间通常并无异样,但约10%的患者存在宫内生长受限。此外,报道27%的PS新生儿小于胎龄。部分患者在新生儿时期就出现贫血、乳酸酸中毒和/或其他器官受累。婴儿早期的临床症状通常是非特异性的,例如肌张力减退、发育不良、呕吐和慢性腹泻。此外,可发生间歇性代谢危象伴乳酸酸中毒。
血液学特征
PS患者表现为大细胞性或正细胞性低增生性贫血。患者可以同时伴有中性粒细胞减少和血小板减少。大多数患者的胎儿血红蛋白(HbF)浓度和促红细胞生成素水平升高。骨髓检查显示有核细胞数量正常或减少,通常各系可见发育不良特征,如髓系成熟障碍。
PS的独特形态学特征是髓系和红系前体细胞胞浆空泡化。铁染色显示70-85%的这些患者中存在环形铁粒幼细胞。虽然骨髓发现环形铁粒幼细胞有助于PS的诊断,但在疾病早期可能并不出现。
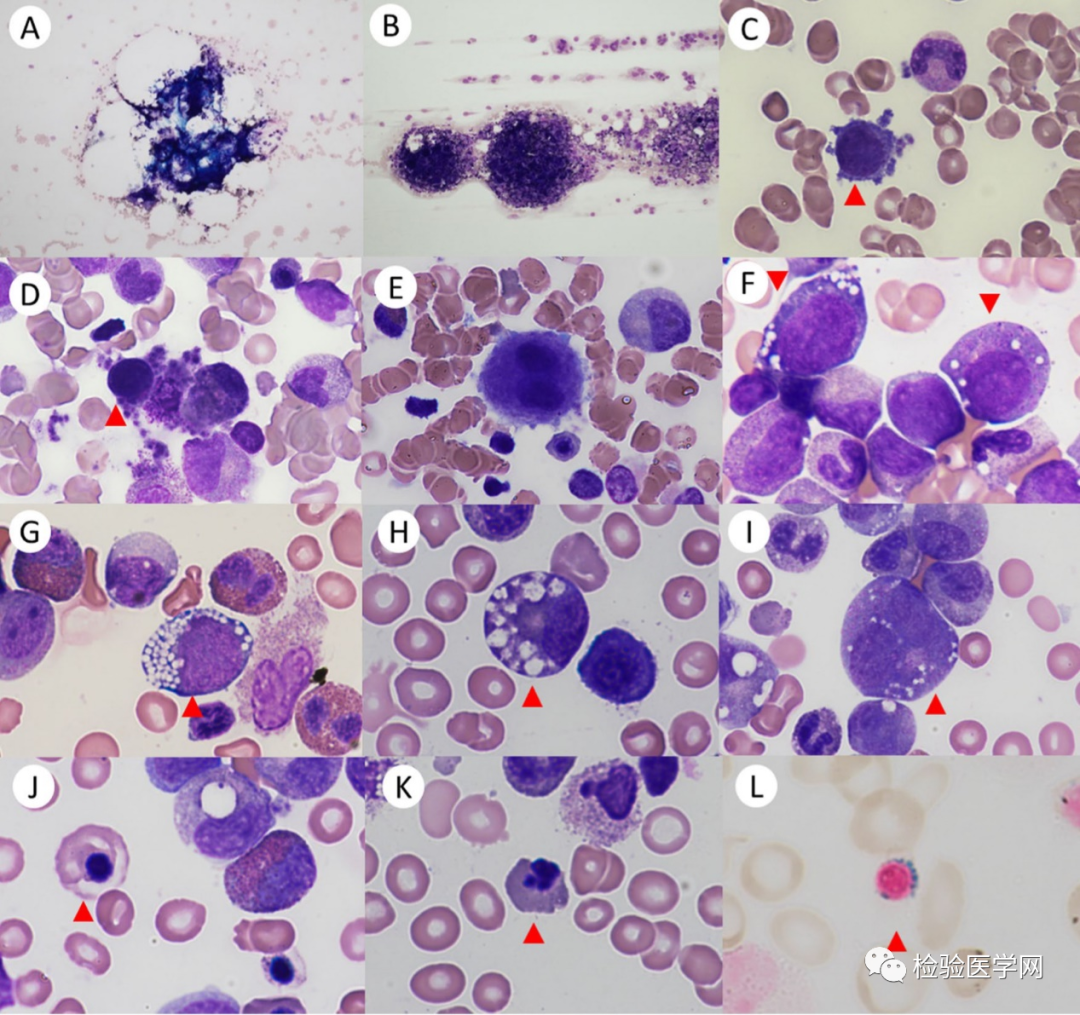
图2 Pearson综合征患者骨髓表现。骨髓可以是增生减低的A型或增生活跃的B型;C+D:小巨核细胞;E:发育不良的双核巨核细胞;F:原红细胞和中幼粒细胞胞浆有空泡;G:原红细胞有空泡;H:中幼粒有空泡;I:双核早幼粒细胞有空泡;J:巨幼样变晚幼红胞浆空晕;K:晚幼红核出芽;L:环形铁粒幼细胞(铁染色)。
实验室检查
PS没有特异性生物标志物。与其他PMD疾病一样,在大多数PS患者中发现血清乳酸浓度升高。但在一些患者中,仅被检测到乳酸与丙酮酸的比值通常高于20。通过气相色谱-质谱法对尿液中的有机酸进行分析,通常会发现乳酸和柠檬酸循环中间产物富马酸和苹果酸的浓度升高。
在一些情况下,可以发现3-甲基戊烯二酸的排泄升高作为线粒体功能障碍的标志物。患者还可表现为尿中3-羟基丁酸浓度升高。氨基酸分析显示大多数患者丙氨酸浓度升高,这可以解释为柠檬酸循环中断导致丙酮酸盐累积,然后可逆地转化为乳酸盐或丙氨酸。PS患者可出现较低的瓜氨酸和精氨酸,其他线粒体病也可以出现,但代谢物模式可有助于PS与其他非线粒体引起的BM衰竭疾病相鉴别诊断。患有PS的儿童还包括评估内分泌和胰腺外分泌功能,通常在诊断时已经存在胰腺功能不全。
总的来说,乳酸、尿有机酸分析和血浆氨基酸分析等代谢检查有助于诊断。在大多数情况下,典型PS骨髓表现为髓系和红系前体细胞胞质存在空泡和环状铁粒幼细胞增多,确诊需要外周血中线粒体DNA的突变分析。
鉴别诊断
PS的血液学特征,如全血细胞减少、HbF和MCV升高、骨髓发育不全和异常与其他先天性BM衰竭疾病相似,例如Diamond-Blackfan贫血(DBA)也表现为先天性骨髓衰竭,Shwachman-Diamond综合征(SDS)患者在幼儿期表现为胰腺外分泌功能不全、发育不良和中性粒细胞减少,在PS中也能观察到这些特征。
实际临床诊断中,PS的BM细胞学可以很好地区分DBA或SDS,因为DBA或SDS骨髓并没有发现髓系和红系前体细胞胞浆空泡和环形铁粒幼细胞。此外,大多数PS婴儿存在两系或三系细胞减少,而DBA和SDS婴儿通常分别存在孤立性贫血或中性粒细胞减少症。有趣的是,PS患者经常报告网织红细胞计数正常,而DBA患者通常有网织红细胞减少。多数DBA患者表现为红细胞腺苷脱氨酶(eADA)水平升高。然而在一些PS患者中也报告了eADA水平升高。
虽然PS的独特形态学特征是髓系和红系前体细胞胞浆空泡和(或)环形铁粒幼细胞,但在其他疾病中也可以见到,例如铜缺乏、锌中毒、核黄素缺乏、核黄素转运蛋白缺乏、急性酒精中毒、苯丙酮尿症、氯霉素和利奈唑胺中毒以及其他PMD。
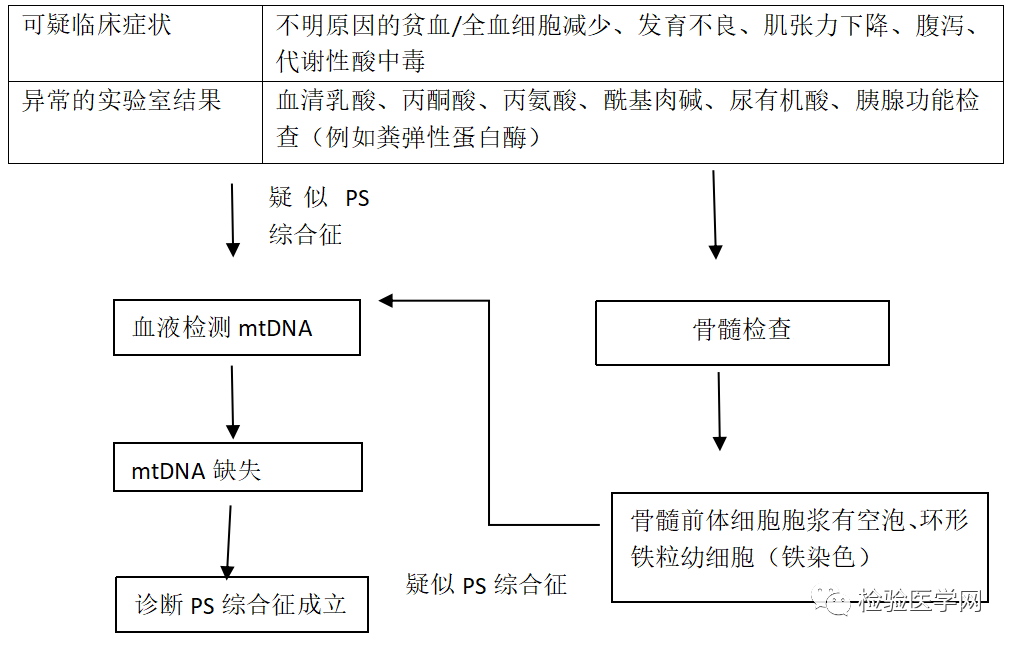
图3 疑似Pearson综合征的诊断流程。建议诊断PS综合征结合患者病史、临床症状和实验室检查结果,关键在于检测血细胞中单个大片段线粒体DNA(mtDNA)缺失和骨髓检查。单个大片段mtDNA缺失也可以存在于其他组织中,例如大多数患者的口腔拭子和/或尿上皮细胞。
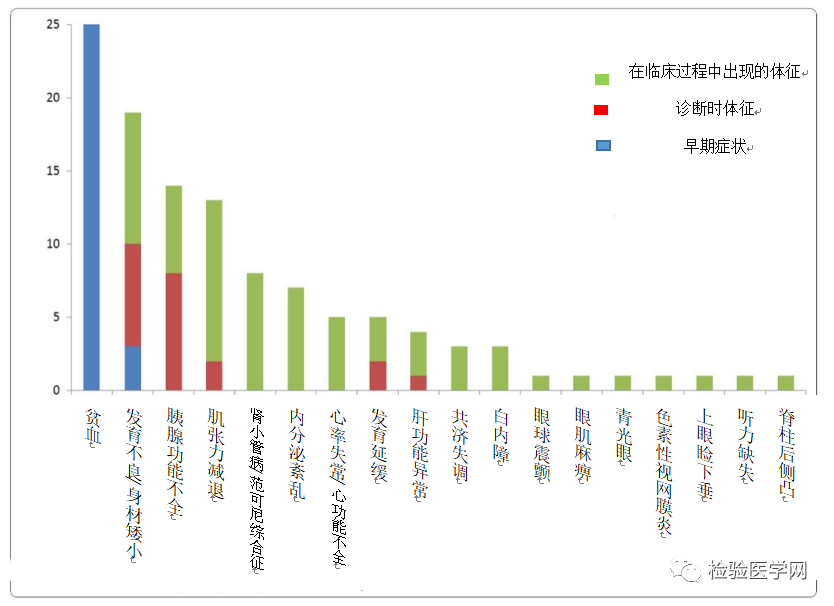
图4显示了在我们先前研究中纳入的25例PS患者中观察到的并发症。
治疗
目前尚无针对PS疾病的特效治疗,但了解PS整个病程史、常见并发症和发病年龄可优化PS的监测和护理,并将发病率降至最低。
由多学科团队定期监测胰腺功能、肾小管功能、多种内分泌功能、心脏功能和随访。必要时为患者和家属提供最佳护理。PS患者通常需要胰酶替代和激素替代治疗。对于严重食欲不振、吞咽困难、喂养困难和发育不良的情况,通常考虑采用管饲,包括经皮内镜胃造口术和/或肠外营养。
由于发热性感染可诱导分解代谢,引起代谢失调,因此预防感染(包括接种疫苗和早期退热药物使用以及抗生素治疗)对于将风险降至最低至关重要。出现心脏传导缺陷的PS患者可能需要介入治疗,如消融和起搏器植入。建议PS患者携带紧急方案,该方案为急诊评估和最佳护理提供必要的信息。
血液学并发症的治疗
粒细胞集落刺激因子(G-CSF)可改善中性粒细胞减少,但促红细胞生成素和艾曲波帕对贫血的作用有限。多次输血可能导致PS患者铁超负荷,铁螯合剂治疗需要仔细权衡贫血自发消退的高发生率、预期寿命短以及螯合药物在PS中的潜在毒性。铁螯合剂治疗PS尚不清楚是否可以延缓器官功能障碍的进展。
由于持续的输血依赖或严重的中性粒细胞减少,造血干细胞移植(HSCT)的适应症在临床实践中经常被讨论。通常在婴儿早期贫血的自发消退率很高,因此不建议在3-4岁之前考虑HSCT。虽然HSCT后可以实现血液学缓解,但HSCT作为PS非血液学并发症治疗的潜在作用尚不清楚。
一项研究表明,在携带mtDNA缺失的线粒体小鼠进行BM移植后,存活期延长、肾衰竭发展延迟和抑制肾细胞凋亡。有趣的是,最近的研究已经证明了在生理和病理条件下各种细胞之间的水平线粒体转移,并且线粒体移植被认为是具有线粒体功能障碍情况下的潜在疗法。最常见的供体细胞是间充质干细胞(MSC),其可以将线粒体注入各种细胞中并拯救受体细胞的有氧呼吸。
此外,最近在小鼠模型中证明了从供体来源的HSC到受损的受体MSC的线粒体转移以及同种异体HSCT后受体MSC的代谢恢复。这项研究表明,移植造血干细胞在一些组织的线粒体功能障碍存在潜在治疗作用。然而,目前尚无充分的证据表明HSCT可以延长PS患者的生存期,改善或预防进行性多器官功能障碍。此外,应考虑HSCT前化疗预处理的不可逆损伤风险和超预期的移植相关并发症。
细胞治疗和未来发展方向
在过去十年中,在开发新的药理学和非药理学治疗(包括用于PMD患者的细胞和基因治疗)方面取得了很大进展。启动了线粒体增强疗法(MAT)的第一个临床试验为患者和家属带来了新的希望。
在该试验中,使用携带正常mtDNA的母体线粒体对G-CSF刺激PS患者的HSC进行离体线粒体扩增。将这些含有正常母体mtDNA的自体HSC再输注到患者体内。与同种异体HSCT相比,这种疗法的优点是可以降低细胞毒性和移植相关并发症。还需要更多研究来评估这种疗法是否可以预防或延迟PS的非血液学并发症的进展。
预后
PS患者预后不佳。在德国/奥地利研究中,约有一半的患者死亡年龄不超过3岁,包括25例PS患者,5岁时的总生存率为58%,中位死亡年龄为49个月。其他2项研究报告了相似的生存率。只有少数PS患者的年龄达到15岁。
目前没有预测因子评估PS患者的预后。代谢危象伴严重且无法控制的乳酸酸中毒是最常见的死亡原因,其次是感染和多器官衰竭,如肝和肾衰竭,心律失常是老年患者死亡的重要原因。
结论
在所有患有低增生性贫血的婴儿中,应排除PS的诊断。儿科医生需要了解PS患者病程中典型的血液学表现、广泛的并发症和临床表型的动态变化。早期诊断是实施对症治疗和家庭遗传咨询的关键。虽然目前还没有治愈手段,但细胞和基因疗法的发展有望为患者及其家人提供一种新的治疗方式和希望。
【参考文献】
[1]Pearson syndrome: a multisystem mitochondrial disease with bone marrow failure. Orphanet J Rare Dis. 2022 Oct 17;17(1):379.
